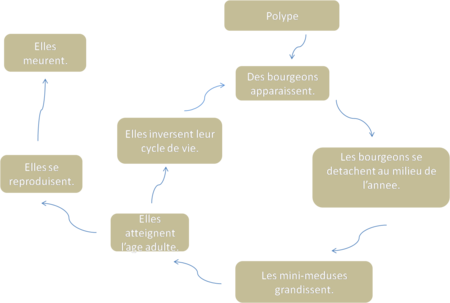
L’équipe japonaise de Shinya Yamanaka a déposé le 1er brevet du monde pour protéger leur découverte de 2006 sur la reprogrammation des cellules souches.
Ils ont tenté de dédifférencier les cellules spécialisées pour qu’elles soient aussi versatiles que les cellules souches embryonnaires.
Comme la plupart des cellules, les cellules souches expriment des gènes particuliers et spécifiques. L’idée de Yamanaka est de chercher parmi ces gènes des gènes maîtres qui contrôlent le destin cellulaire. Si on exprime artificiellement ces gènes maîtres dans une cellule adulte, l’espoir est qu’ils reprogramment la cellule et lui ordonnent de redevenir cellule souche. Yamanaka sélectionne 24 gènes connus pour être exprimés dans les cellules souches chez la souris. Il pense que parmi ces 24 gènes se trouvent les gènes maîtres des cellules souches, ceux qui contrôlent le destin cellulaire. Il prend alors des copies de ces 24 gènes, les intègre dans le génome de cellules de souris adultes avec un rétrovirus pour les surexprimer. Au bout de quelques jours, plusieurs cellules adultes reviennent à l’état de cellules souches. Il doit alors identifier la combinaison minimale des gènes, et finit avec 4 gènes appelés Oct3/4, Sox2, Klf4 et c-Myc. Les cellules adultes retournent à l’état de cellules souches, et Yamanaka montre qu’elles sont également capables de se redifférencier en n’importe quel type de cellule : elles sont donc bien pluripotentes. Il les baptise alors " cellules souches pluripotentes induites " (iPS)
-Qu’est-ce qu’une cellule iPS ?
Une cellule IPS est une cellule souche pluripotente (de l’anglais : induced pluripotent stem cell) qui se comporte comme les cellules souches embryonnaires. Elle en est différente par son origine : en effet, les cellules souches embryonnaires proviennent de l’embryon, alors que les cellules souches IPS proviennent des cellules adultes spécialisées qui se sont dédifférenciées.
- Quelle est la différence avec les cellules souches adultes ?
Les cellules souches adultes (comme celles de la moelle épinière) sont déjà partiellement différenciées. En fait, une cellule souche de la moelle épinière peut se différencier en une cellule sanguine, mais pas en un neurone. Les cellules IPS ne sont pas du tout différenciées. Elles peuvent donner naissance à n’importe quel type de cellule.
Le seul problème est que les cellules souches ont un génome modifié et peuvent potentiellement provoquer des cancers.
Comment ces 4 facteurs insérés peuvent-ils causer le cancer ?
Il existe en fait dans la cellule un gène suppresseur de tumeur : le gène P53. Ce gène arrête les cellules devenues cancérigènes, mais fait aussi barrière à la reprogrammation des cellules adultes en cellules souches. Lors de l’expérience menée par l’équipe de Yamanaka, peu de cellules souches ont pu se dédifférencier en cellules iPS : les deux facteurs oncogènes Klf 4 et c-myc ont activé le gène P53 qui a bloqué la reprogrammation de la cellule. Si on inactive le gène P53, la reprogrammation serait dix fois plus rapide et ne nécessitera pas de stimulants oncogènes. Cependant, il y aura un grand risque de cancer car le gène P53 est le gardien de la stabilité du chromosome.
D’après les papiers de fin 2007, on peut appliquer la même technique aux cellules humaines. La prochaine étape est d’arriver à fabriquer des cellules iPS sans l’étape d’intégration des 4 gènes par rétrovirus qui modifie le génome des cellules et est vraisemblablement la cause des cancers.
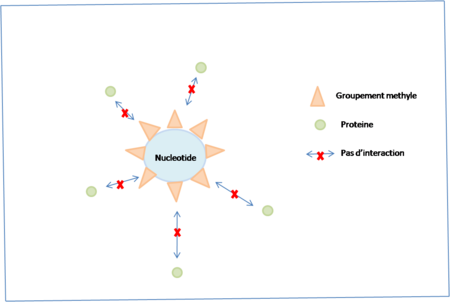
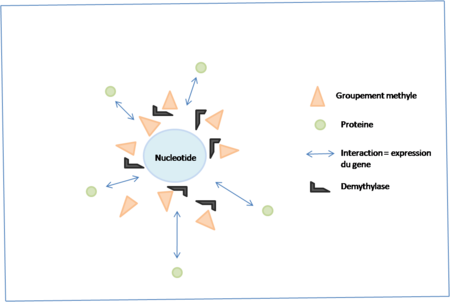
Cependant, la transdifférenciation n’est pas la seule piste plausible : en effet, on pourrait s’intéresser à l’enzyme déméthylase présente chez les cèdres et qui permet le renouvellement cellulaire continu. Mais nous ne disposons encore que de très peu d’informations sur cette enzyme et les gènes qui la codent.